Wofür steht DSC? Erläutern sie das Vorgehen bei der DSC-Analyse!
Differential Scanning Calorimetry (Dynamische Differentialkalorimetrie)
Eine Probe in einem verkapselten Behälter und ein zweiter Behälter ohne Inhalt (Referenz) werden einem gleichartigen Temperaturprogramm ausgesetzt.
Infolge der Wärmekapazität und Umwandlung in der Probe kommt es zu Temperaturdifferenzen gegenüber der Referenz
Eine Probe in einem verkapselten Behälter und ein zweiter Behälter ohne Inhalt (Referenz) werden einem gleichartigen Temperaturprogramm ausgesetzt.
Infolge der Wärmekapazität und Umwandlung in der Probe kommt es zu Temperaturdifferenzen gegenüber der Referenz
Was sind "Entanglements"? Was ist das "Entanglementmolekulargewicht"?
Entanglements:
Verschlaufungen verschiedener Polymerkknäuele.
Entanglement Molekulargewicht:
Das Molekulargewicht, bei dem im Schmelzviskositäts-Diagramm
die Steigung von m=1 auf m=3,4 knickt.
Verschlaufungen verschiedener Polymerkknäuele.
Entanglement Molekulargewicht:
Das Molekulargewicht, bei dem im Schmelzviskositäts-Diagramm
die Steigung von m=1 auf m=3,4 knickt.
Tags: Schmelzviskosität
Source:
Source:
Wie ändert sich die Schmelzviskosität eines Polymers a) unterhalb und b) oberhalb des Entanglementmolekulargewichtes?
c) Berechnen Sie die Änderung der Schmelzviskosität bei Verdoppelung des Polymerisationsgrades für den Fall b) !
c) Berechnen Sie die Änderung der Schmelzviskosität bei Verdoppelung des Polymerisationsgrades für den Fall b) !
a) Die Schmelzeviskosität steigt doppelt logarithmisch aufgetragen mit der Steigung m=1.
Die Knäuele liegen nebeneinander vor.
b) Die Schmelzeviskosität steigt doppelt logarithmisch aufgetragen mit der Steigung m=3.4
Die Knäuele verschlaufen miteinander.
c)

Verdoppelung von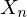 fürt zu Verdoppelung von
fürt zu Verdoppelung von 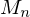 :
:
folgt:
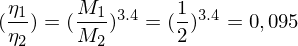
Die Knäuele liegen nebeneinander vor.
b) Die Schmelzeviskosität steigt doppelt logarithmisch aufgetragen mit der Steigung m=3.4
Die Knäuele verschlaufen miteinander.
c)

Verdoppelung von
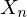 fürt zu Verdoppelung von
fürt zu Verdoppelung von 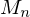 :
:folgt:
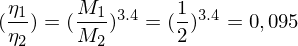
Wie ist der Polydispersitätsindex Definiert und was sagt er aus?
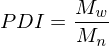
Er beschreibt die Breite der Molekulargewichtsverteilung. Werte zwischen 1,5 und 2 sind akzeptabel und in der Realität erreichbar. Für den theoretischen Grenzfall bei PDI = 1, spricht man von einem Monodispersen Polymer, d.h. alle Ketten wären gleich lang.
Beschreiben Sie die Massepolymerisation (bulkpolymerisation) und benennen Sie Produktbeispiele sowie Vor- und Nachteile
Massepolymerisation = Polymerisation der reinen Monomeren
Ethylen, Styrol, Methylmethacrylat
+ reine Polymre (kein Lösungsmittelrest)
- Produkt mit Monomer kontaminiert
- Probleme die Reaktionswärme abzuführen
- Probleme mit der hohen Viskosität ("hot spots")
Ethylen, Styrol, Methylmethacrylat
+ reine Polymre (kein Lösungsmittelrest)
- Produkt mit Monomer kontaminiert
- Probleme die Reaktionswärme abzuführen
- Probleme mit der hohen Viskosität ("hot spots")
Beschreiben Sie die beiden Polymerisationsmechanismen
A) Lösungspolymerisation
B) Fällungspolymerisation
und benennen Sie Produktbeispiele sowie Vor- und Nachteile
A) Lösungspolymerisation
B) Fällungspolymerisation
und benennen Sie Produktbeispiele sowie Vor- und Nachteile
A)
Polymerisation von gelösten Monomeren ( Vinylacetat, Acrylonitril)
+ einfache Kontrolle der Wärmeabgabe
+ keine Viskositätsprobleme
- Produkt mit (organischen) Lösungsmitteln kontaminiert
- teuer, Umweltproblematik mit org. Lösungsmitteln
B)
Polymer fällt während der Reaktion aus ( Vinylchlorid, Acrylonitril)
+ sehr reine Polymere
+ einfache Kontrolle der Wärmeabgabe
+ keine Viskositätsprobleme
- Produkt mit (organischen) Lösungsmitteln kontaminiert
- teuer, Umweltproblematik mit org. Lösungsmitteln
- nicht allgemein anwendbar
Polymerisation von gelösten Monomeren ( Vinylacetat, Acrylonitril)
+ einfache Kontrolle der Wärmeabgabe
+ keine Viskositätsprobleme
- Produkt mit (organischen) Lösungsmitteln kontaminiert
- teuer, Umweltproblematik mit org. Lösungsmitteln
B)
Polymer fällt während der Reaktion aus ( Vinylchlorid, Acrylonitril)
+ sehr reine Polymere
+ einfache Kontrolle der Wärmeabgabe
+ keine Viskositätsprobleme
- Produkt mit (organischen) Lösungsmitteln kontaminiert
- teuer, Umweltproblematik mit org. Lösungsmitteln
- nicht allgemein anwendbar
Beschreiben Sie die Suspensionspolymerisation (Perlpolymerisation) und bennenen Sie Produktbeispiele sowie Vor- und Nachteile
"Wassergekühlte Massepolymerisation"
Dispersion von Polymertröpfchen in Wasser, monomerlöslicher Initiator + "Schutzkolloid"
(Styrol, Acryl- & Methacrylester, VC, VAc, TFE)
+ excellente Wärmeabgabe
+ keine Viskositätsproblem auch nicht bei hohen Monomeranteilen
+ Produkt entsteht in Form kleiner Perlen (50 µm - mm Bereich)
- Stabilisator ("Schutzkolloid") bleibt im Polymer
Dispersion von Polymertröpfchen in Wasser, monomerlöslicher Initiator + "Schutzkolloid"
(Styrol, Acryl- & Methacrylester, VC, VAc, TFE)
+ excellente Wärmeabgabe
+ keine Viskositätsproblem auch nicht bei hohen Monomeranteilen
+ Produkt entsteht in Form kleiner Perlen (50 µm - mm Bereich)
- Stabilisator ("Schutzkolloid") bleibt im Polymer
Beschreiben Sie die Emulsionspolymerisation, benennen Sie Produktbeispiele sowie Vor- und Nachteile
Emulsion von Monomer und Tensid in Wasser, wasserlöslicher Initiator
( Synthesekautschuk, u.a. )
+ excellente Wärmeabgabe
+ keine Viskositätsprobleme auch nicht bei hohen Monomeranteilen
+ Produkt entsteht in Form kleiner Perlen (50 µm - mm Bereich)
+ gehorcht einem eigenen Reaktionsmechanismus
+ Produkt entsteht in Form eines Polymerlatex
- Tensid bleibt im Polymer
- keine einfache Abtrennung des Polymers aus dem Latex
( Synthesekautschuk, u.a. )
+ excellente Wärmeabgabe
+ keine Viskositätsprobleme auch nicht bei hohen Monomeranteilen
+ Produkt entsteht in Form kleiner Perlen (50 µm - mm Bereich)
+ gehorcht einem eigenen Reaktionsmechanismus
+ Produkt entsteht in Form eines Polymerlatex
- Tensid bleibt im Polymer
- keine einfache Abtrennung des Polymers aus dem Latex
Wie lange muss man ein gemisch aus 0.5 mol/L Ethylenglykol (1,2-Ethandiol) und 0.5 mol/L Terephthalsäure (Phenyldisäure) reagieren lassen, damit das entstehende Poly(ethylenterephtalat) ein Molekulargewicht von 19200 g/mol erhält?
Berechnen Sie die Reaktionszeit jeweils für Fremd- und Eigenkatalyse mit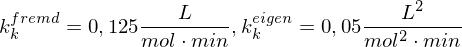
Berechnen Sie die Reaktionszeit jeweils für Fremd- und Eigenkatalyse mit
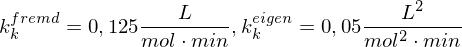
Molmasse der Wiederholungseinheit berechnen:

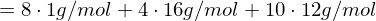
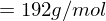
Polymerisationsgrad bestimmen:
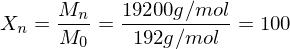
Eigenkatalyse:
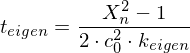
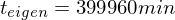
Fremdkatalyse:
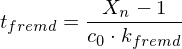
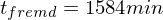

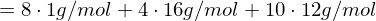
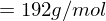
Polymerisationsgrad bestimmen:
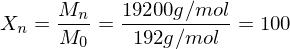
Eigenkatalyse:
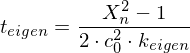
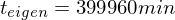
Fremdkatalyse:
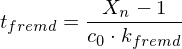
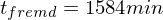
Erläutern Sie den Vorgang der Emulsionspolymerisation. Welchen Einfluss hat die Konzentration an Initiator und die von aktiven Mizellen auf den Polymerisationsgrad, bzw. die Polymerisationsgeschwindigkeit?
Ein Radikal tritt in eine Mizelle ein und wächst, bis ein zweites eintritt und die Reaktion abbricht.
Danach ruht die Mizelle wieder, bis erneut ein Radikal eintritt, usw.
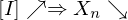
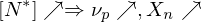
Danach ruht die Mizelle wieder, bis erneut ein Radikal eintritt, usw.
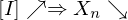
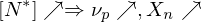
Tags: Emulsionspolymerisation
Source:
Source:
Welche drei Phasen durchläuft die Emulsionspolymerisation, beschreiben Sie, was in diesen Phasen geschieht.
Phase I:
Polymerisation des in den Micellen vorhandenen Monomers
- Teilchenbildung
- Zahl der Reaktionszentren steigt
- Latexteilchen werden größer
-Kinetik 1. Ordnung
-Geschwindigkeit steigt erst sehr schnell, nimmt dann ab.
- viele Tenside halten die Oberflächenspannung gering
Phase II:
Polymerisation des Nachgelieferten Monomers in den Micellen
- Keine neue Bildung von Reaktionszentren
- Bruttogeschwindigkeit = 0
- Kinetik 0. Ordnung
- Durch das Einbinden der Tenside ist die Oberflachenspannung stark gestiefen (senkrechte zu Beginn von Phase II )
Phase III:
Polymerisation des restlichen Monomers in den Micellen
- Monomertröpfchen verbraucht
- Kinetik 1.Ordnung
- Geschwindigkeit nimmt erst schnell ab, dann etwas langsamer
- Oberflachenspannung mit sehr flacher, geringer Steigung
Polymerisation des in den Micellen vorhandenen Monomers
- Teilchenbildung
- Zahl der Reaktionszentren steigt
- Latexteilchen werden größer
-Kinetik 1. Ordnung
-Geschwindigkeit steigt erst sehr schnell, nimmt dann ab.
- viele Tenside halten die Oberflächenspannung gering
Phase II:
Polymerisation des Nachgelieferten Monomers in den Micellen
- Keine neue Bildung von Reaktionszentren
- Bruttogeschwindigkeit = 0
- Kinetik 0. Ordnung
- Durch das Einbinden der Tenside ist die Oberflachenspannung stark gestiefen (senkrechte zu Beginn von Phase II )
Phase III:
Polymerisation des restlichen Monomers in den Micellen
- Monomertröpfchen verbraucht
- Kinetik 1.Ordnung
- Geschwindigkeit nimmt erst schnell ab, dann etwas langsamer
- Oberflachenspannung mit sehr flacher, geringer Steigung
Was bedeutet "Ceiling Temperature" und wie wird sie berechnet?
Eine Chemische Reaktion läuft nur ab, wenn gilt:

Da eine Polymerisation in der Regel unter Entropieverminderung abläuft,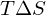 mit steigender Temperatur aber größer wird, existiert eine Temperatur
mit steigender Temperatur aber größer wird, existiert eine Temperatur 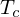 , bei der
, bei der 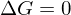 wird und die Reaktion praktisch beendet ist.
wird und die Reaktion praktisch beendet ist.
Dieser Temperatur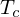 wird Ceiling-Temperature genannt.
wird Ceiling-Temperature genannt.
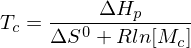
Alternativ: Neben der Polymerisation (Entropieabnahme) findet mit steigender Temperatur auch Depolymerisation statt (Entropiezunahme). Sind die Geschwindigkeiten der Vorgänge gleich, also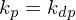 dann geschieht dies bei eben der Ceiling Temperatur. Steigt die Temperatur, wird
dann geschieht dies bei eben der Ceiling Temperatur. Steigt die Temperatur, wird 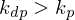 und die Reaktion führt nicht mehr zum gewünschten Ergebnis.
und die Reaktion führt nicht mehr zum gewünschten Ergebnis.

Da eine Polymerisation in der Regel unter Entropieverminderung abläuft,
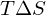 mit steigender Temperatur aber größer wird, existiert eine Temperatur
mit steigender Temperatur aber größer wird, existiert eine Temperatur 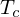 , bei der
, bei der 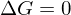 wird und die Reaktion praktisch beendet ist.
wird und die Reaktion praktisch beendet ist.Dieser Temperatur
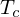 wird Ceiling-Temperature genannt.
wird Ceiling-Temperature genannt.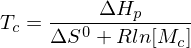
Alternativ: Neben der Polymerisation (Entropieabnahme) findet mit steigender Temperatur auch Depolymerisation statt (Entropiezunahme). Sind die Geschwindigkeiten der Vorgänge gleich, also
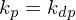 dann geschieht dies bei eben der Ceiling Temperatur. Steigt die Temperatur, wird
dann geschieht dies bei eben der Ceiling Temperatur. Steigt die Temperatur, wird 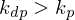 und die Reaktion führt nicht mehr zum gewünschten Ergebnis.
und die Reaktion führt nicht mehr zum gewünschten Ergebnis.Was sind Initiatoren und welche Funktion erfüllen Sie bei der radikalischen Polymerisation?
Welche thermischen und welche Photoinitiatoren kenne Sie?
Welche thermischen und welche Photoinitiatoren kenne Sie?
Initiatoren sind Moleküle, die unter bestimmten Bedingungen Radikale bilden , die
- reaktiver als das Monomer-/Polymerradikal sind
- eine ausreichende Lebensdauer besitzen, um mit Monomeren zu reagieren
Sie starten die radikalische Polymerisation.
Thermische Initiatoren:
- AIBN (Azo-bis-(isobutyronitril))
- BPO (Dibenzoylperoxid)
Photoinitiatoren:
- AIBN
- reaktiver als das Monomer-/Polymerradikal sind
- eine ausreichende Lebensdauer besitzen, um mit Monomeren zu reagieren
Sie starten die radikalische Polymerisation.
Thermische Initiatoren:
- AIBN (Azo-bis-(isobutyronitril))
- BPO (Dibenzoylperoxid)
Photoinitiatoren:
- AIBN
Für welche Annahmen gilt die kinetische Betrachtung der Polymerisation?
Sie gilt nur unter der Annahme, dass:
- während der Reaktion überwiegend Bedingungen des statischen Zustandes vorherrschen
- die Reaktivität der Radikale unabhängig von der Kettenlänge ist
- keine Kettenübertragung stattfindet
- keine Selbsbeschleunigung auftritt
- während der Reaktion überwiegend Bedingungen des statischen Zustandes vorherrschen
- die Reaktivität der Radikale unabhängig von der Kettenlänge ist
- keine Kettenübertragung stattfindet
- keine Selbsbeschleunigung auftritt
Erklären Sie den Trommsdorf-Norrish-Effekt
Geleffekt (Selbstbeschleunigung der Polymerisation):
Bei hohen Umsätzen und hohen Polymerkonzentrationen steigt die Lösungsviskosität stark an.
-> Diffusion großer Kettenmoleküle sterisch gehindert
-> Abbruchreaktion wird verlangsamt
Niedermolekulare Monomere können leicht in große Kettenradikale eindringen, daher wird Kettenwachstum nicht verhindert
1. Initiierung
3. Monomerkonzentration nimmt durch Verbrauch stark ab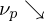
Geleffekt: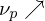
5. Glaseffekt: Polymermoleküle und -radikale so groß und unbeweglich, dass das Reaktionsgemisch langsam erstarrt

Bei hohen Umsätzen und hohen Polymerkonzentrationen steigt die Lösungsviskosität stark an.
-> Diffusion großer Kettenmoleküle sterisch gehindert
-> Abbruchreaktion wird verlangsamt
Niedermolekulare Monomere können leicht in große Kettenradikale eindringen, daher wird Kettenwachstum nicht verhindert
1. Initiierung
3. Monomerkonzentration nimmt durch Verbrauch stark ab
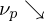
Geleffekt:
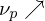
5. Glaseffekt: Polymermoleküle und -radikale so groß und unbeweglich, dass das Reaktionsgemisch langsam erstarrt

Was sind Inhibitoren, was sind Retarder?
Inhibitoren werden angewendet um Polymerisationen zu verhindern (Stabilisieren von Monomeren) oder eine laufende Polymerisation zu beenden.

desto stärker inhibierend wirkt der Inhibitor.
Inhibitoren werden verbraucht. Danach startet die Polymerisation.
Substanzen mit kleinem z nennt man "Retarder". Sie verzögern die Reaktion.
Bsp.
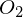 als Inhibitor:
als Inhibitor:
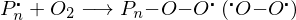

desto stärker inhibierend wirkt der Inhibitor.
Inhibitoren werden verbraucht. Danach startet die Polymerisation.
Substanzen mit kleinem z nennt man "Retarder". Sie verzögern die Reaktion.
Bsp.
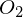 als Inhibitor:
als Inhibitor: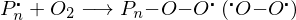
Wie ist die Transferkonstante definiert?
Transferkonstante:
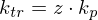
Abbruchgeschwindigkeit wird bestimmt duch z-Wert des Inhibitors multipliziert mit der Polymerisationskonstante.
Je größer z, also kp << ktr , desto stärker der Inhibitor(Überträger, Transferreaktionsbeschleuniger).
Substanzen mit im Verhältnis zu kp sehr kleinem z, also auch kp >> ktr wirken als Retarder
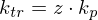
Abbruchgeschwindigkeit wird bestimmt duch z-Wert des Inhibitors multipliziert mit der Polymerisationskonstante.
Je größer z, also kp << ktr , desto stärker der Inhibitor(Überträger, Transferreaktionsbeschleuniger).
Substanzen mit im Verhältnis zu kp sehr kleinem z, also auch kp >> ktr wirken als Retarder
Wie funktioniert Endkapping
Nach der Ringöffnenden Polymerisation, bei der am Ende der Ketten ein -OH und ein -H steht, werden die Hs durch eine Säure irreversibel ersetzt, damit kein Backbiting auftritt.
Tags: Ionische Polymerisation
Source:
Source:
Woraus besteht ein Ziegler-Natta-Katalysator?
Ziegler-Natta Katalysator besteht aus einer Kombination von:
Sechste Generation von Z-N Kat.: Zirconocene + MAO
| Metallalkyl oder Metall-Alkylhalogenid der I-III Hauptgruppe (z.B Al(C2H5)3) |
| + |
| Übergangsmetallhalogenid, -hydroxyd, -oxyd, alkoxyd der IV-VIII Nebengruppe (z.B. TiCl4) |
Sechste Generation von Z-N Kat.: Zirconocene + MAO
Wodurch ist lebende Polymerisation gekennzeichnet?
- das Fehlen von Abbruch- und Übertragungsreaktionen
- gleichzeitiges Wachstum aller Polymerketten zu gleicher Länge
- enge Molekulargewichtsverteilung PDI nur wenig über 1
PDI nur wenig über 1
- lineare Zunahme des mittleren Polymerisationsgrades mit dem Umsatz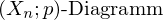
- eine Kontrolle des maximal erreichbaren Polymerisationsgrades durch das Monomer-/Initiator-Molverhältnis
- gleichzeitiges Wachstum aller Polymerketten zu gleicher Länge
- enge Molekulargewichtsverteilung
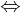 PDI nur wenig über 1
PDI nur wenig über 1- lineare Zunahme des mittleren Polymerisationsgrades mit dem Umsatz
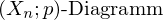
- eine Kontrolle des maximal erreichbaren Polymerisationsgrades durch das Monomer-/Initiator-Molverhältnis
Was geschieht bei der lebenden Polymerisation, wenn das Monomer verbraucht ist?
Was geschieht, wenn man ein anderes Monomer als das erste zugibt?
Worin bestehen die Vorteile der lebenden Polymerisation?
Was geschieht, wenn man ein anderes Monomer als das erste zugibt?
Worin bestehen die Vorteile der lebenden Polymerisation?
Ist das Monomer verbraucht, sind die Kettenenden weiterhin reaktiv ("lebend"), und das Kettenwachstum setzt sich bei erneuter Monomerzugabe fort.
Wird ein anderes Monomer zugesetzt, entsteht ein Blockcopolymer mit definierten Blocklängen.
Vorteile:
+ höchste Kontrolle der Kettenlänge
+ höchste Kontrolle der Polymerstruktur
Wird ein anderes Monomer zugesetzt, entsteht ein Blockcopolymer mit definierten Blocklängen.
Vorteile:
+ höchste Kontrolle der Kettenlänge
+ höchste Kontrolle der Polymerstruktur
Was ist bei der freien radikalischen Polymerisation FRP bimolekularer Abbruch und wie wird er verhindert?
Bimolekularer Abbruch:
Radikalische Polymere reagieren untereinander.
Lösung:
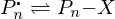
aktives Ende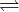 Schlafendes Ende, das nicht wächst, aber aktiviert werden kann.
Schlafendes Ende, das nicht wächst, aber aktiviert werden kann.
(Ähnlich "Lebendes Kettenwachstum")
Radikalische Polymere reagieren untereinander.
Lösung:
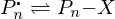
aktives Ende
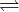 Schlafendes Ende, das nicht wächst, aber aktiviert werden kann.
Schlafendes Ende, das nicht wächst, aber aktiviert werden kann.(Ähnlich "Lebendes Kettenwachstum")
Worin unterscheidet sich die kationische von der anionischen Polymerisation?
In ihren Mechanismen:
Kationisch: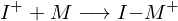
Anionisch:
Wobei I der Initiator und M das Monomer darstellt
Kationisch:
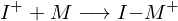
Anionisch:

Wobei I der Initiator und M das Monomer darstellt
Tags: Ionische Polymerisation
Source:
Source:
Bei welchen Monomeren kommt kationische, bei welchen anionische Polymerisation vor?
Was ist bei Doppelbindungen zu beachten?
Was ist bei Doppelbindungen zu beachten?
Kationische Polymerisation nur bei elektronenreichen Monomeren.
Anionische nur bei elektronenarmen Monomeren.
Elektronenziehende Gruppen verringern die Elektronendichte in der Doppelbindung!
Anionische nur bei elektronenarmen Monomeren.
Elektronenziehende Gruppen verringern die Elektronendichte in der Doppelbindung!
Tags: Ionische Polymerisation
Source:
Source:
Tags: Ionische Polymerisation
Source:
Source:
Tags: Ionische Polymerisation
Source:
Source:
Beschreiben sie die Copolymerisation nach dem Terminalmodell.
Terminalmodell: Copolymerisation von Monomer A mit Monomer B
mit rA und rB als Copolymerisationsparameter
Folgt:
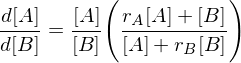
mit rA und rB als Copolymerisationsparameter
Folgt:
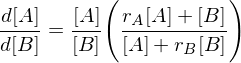
Tags: Copolymerisation, Terminalmodell
Source:
Source:
Wie lauten die Regeln des Q,e-Schemas?
1) Monomere, die dich stark in ihren Q-Werten unterscheiden, -> schlecht
2) Monomere die ähnliche, am besten hohe Q-Werte haben -> sehr gut
3) e-Werte stark unterschiedlich -> tendieren zu Alternanz
4) ähnliche Q,e-Werte -> Statistische Copolymere zu erwarten
2) Monomere die ähnliche, am besten hohe Q-Werte haben -> sehr gut
3) e-Werte stark unterschiedlich -> tendieren zu Alternanz
4) ähnliche Q,e-Werte -> Statistische Copolymere zu erwarten
Tags: Copolymerisation
Source:
Source:
Welche Kohäsionskräfte gibt es in Polymeren?
1. Chemische Bindungen
2. Vernetzungspunkte
3. Zwischenmolekulare Wechselwirkungen
4. Verschlaufungen
2. Vernetzungspunkte
3. Zwischenmolekulare Wechselwirkungen
4. Verschlaufungen
Tags: Klebstoffe
Source:
Source:
Einteilung nach welchen Verfestigungsmechanismen?
Physikalisch abbindend (z.B. Schmelzklebstoffe oder Lösemittelhaltige Nassklebstoffe)
Chemisch härtend (Polykondensationsklebstoffe, Polyadditionsklebstoffe, Polymerisationsklebstoffe)
Ohne Verfestigungsmechanismus (Haftklebstoffe)
Chemisch härtend (Polykondensationsklebstoffe, Polyadditionsklebstoffe, Polymerisationsklebstoffe)
Ohne Verfestigungsmechanismus (Haftklebstoffe)
Tags: Klebstoffe
Source:
Source:
Tags: Klebstoffe
Source:
Source:
Welche Lösungsmittelhaltigen Nassklebstoffe kenne Sie?
Wie wirken diese? Welche Probleme können auftreten?
Wie wirken diese? Welche Probleme können auftreten?
Polyvinylacetat [CH2-CH(OC(O)CH3)]n
Polymethylmethacrylat [CH2-CH(CH3)(C(O)OCH3)]n
Nitrilkautschuk
Polyvinylchlorid [CH2-CH(Cl)]n
Durch verdunsten des Lösungsmittels bilden sich Zwischenmolekulare Kräfte aus
- Lösungsmittel muss verdunsten können
- Gefahr von Crazing (Schrumpfrisse der angelösten Oberflächen)
Polymethylmethacrylat [CH2-CH(CH3)(C(O)OCH3)]n
Nitrilkautschuk
Polyvinylchlorid [CH2-CH(Cl)]n
Durch verdunsten des Lösungsmittels bilden sich Zwischenmolekulare Kräfte aus
- Lösungsmittel muss verdunsten können
- Gefahr von Crazing (Schrumpfrisse der angelösten Oberflächen)
Was sind Plastisole?
Wie werden sie verarbeitet?
Wie werden sie verarbeitet?
Plastisole:
Paste aus hartem PVC-Korn in flüssigem Weichmacher
Verarbeitung:
1. Anquellen der Paste bei 40°C
2. Vorgelieren ab 100 bis 120°C
3. Sol-Gel-Prozess bei 160 bis 180°C
Irreversible Reaktion
Paste aus hartem PVC-Korn in flüssigem Weichmacher
Verarbeitung:
1. Anquellen der Paste bei 40°C
2. Vorgelieren ab 100 bis 120°C
3. Sol-Gel-Prozess bei 160 bis 180°C
Irreversible Reaktion
Tags: Klebstoffe, Plastisole
Source:
Source:
Welche zwei Unterscheidungen gibt es bei Chemisch härtenden Klebstoffen?
1-Komponentig:
Harz und Härter bereits gemischt. Abbindungsstart durch Temperator, Feuchtigkeit oder Sauerstoff.
2-Komponentig:
Die Reaktionspartner liegen getrennt vor und werden erst kurz vor der Verwendung gemischt.
Reaktionspartner: Monomer oder Präpolymer (Harz) und Initiator oder Vernetzer (Härter)
Harz und Härter bereits gemischt. Abbindungsstart durch Temperator, Feuchtigkeit oder Sauerstoff.
2-Komponentig:
Die Reaktionspartner liegen getrennt vor und werden erst kurz vor der Verwendung gemischt.
Reaktionspartner: Monomer oder Präpolymer (Harz) und Initiator oder Vernetzer (Härter)
Tags: Klebstoffe, Reaktionsharze
Source:
Source:
Welche Haftklebstoffe kennen Sie?
Isopren
Butylkautschuk (IRR)
SIS (Styrol-Isopren-Blockcopolymer)
SBS (Styrol-Butadien-Blockcopolymer)
Butylkautschuk (IRR)
SIS (Styrol-Isopren-Blockcopolymer)
SBS (Styrol-Butadien-Blockcopolymer)
Tags: Haftklebstoffe, Klebstoffe
Source:
Source:
Wie härten Cyanacrylat-Klebstoffe aus?
1. Durch anionische Polymerisation
2. Durch Hydrolyse des Cyanacrylates
2. Durch Hydrolyse des Cyanacrylates
Tags: Klebstoffe
Source:
Source:
Beschreiben Sie das Flory-Prinzip
Zur Vereinfachung werden alle Gruppen als gleich reaktiv angesehen, d.h. die Geschwindigkeit der Reaktion zweier Monomere zu einem Dimer ist gleich der von einem Monomer mit einem Polymer der Kettenlänge n zur Kettenlänge n+1
In der Realität sind die Geschwindigkeiten nicht gleich, die Reaktivität nimmt mit steigender Kettenlänge ab.
ABER: Ab n ≈ (5...10) unterscheidet dich die Reaktivität der funktionellen Gruppen von n-meren praktisch nicht mehr
In der Realität sind die Geschwindigkeiten nicht gleich, die Reaktivität nimmt mit steigender Kettenlänge ab.
ABER: Ab n ≈ (5...10) unterscheidet dich die Reaktivität der funktionellen Gruppen von n-meren praktisch nicht mehr
Tags: Stufenwachstumsreaktionen
Source:
Source:
Welche Thermoplastischen Elastomersysteme kennen Sie?
1. Dreiblockcopolymere (Polystyrol-Blockcopolymere)
2. Multiblock-Copolymere
3. Polymermischungen (Thermoplatic Elastomer Blends)
ca. 50% aller TPE sind Kategorie 1
2. Multiblock-Copolymere
3. Polymermischungen (Thermoplatic Elastomer Blends)
ca. 50% aller TPE sind Kategorie 1
Tags: TPE
Source:
Source:
Wie setzt sich ein TPE vom Typ 3 zusammen?
a) Physikalische Mischung aus einem unvernetzten thermoplastischen Elastomer und einem harten Thermoplasten
b) Physikalische Mischung aus einem chemisch vernetzten Elastomer und einem harten Thermoplasten (durch vernetzen kein Fließen -> temperaturbeständiger)
b) Physikalische Mischung aus einem chemisch vernetzten Elastomer und einem harten Thermoplasten (durch vernetzen kein Fließen -> temperaturbeständiger)
Tags: TPE
Source:
Source:
Warum TPE?
+ Ersatz von vulkanisiertem Naturkautschuk
+ Verarbeitung im Spritzgießprozess möglich
+ Verarbeitung im Spritzgießprozess möglich
Tags: TPE
Source:
Source:
Wie lautet die erweiterte Carothers-Gleichung, die auch das Mischungsverhältnis mit einbezieht?
Welche Aussage kann man ihr entnehmen?
Welche Aussage kann man ihr entnehmen?
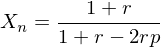
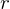 ist das Mischungsverhältnis
ist das MischungsverhältnisAussage:
Kleinste Abweichungen im Mischungsverhältnis führen zu drastischen Änderungen im Molekulargewicht!
Die stöchiometrische Einwaage der Reaktionspartner ist noch viel wichtiger als die Vollständigkeit des Umsatzes!
Genaue stöchiometrische Kontrolle der Reaktion erforderlich.
 Es sind hochreine Monomere erforderlich!
Es sind hochreine Monomere erforderlich!
Flashcard set info:
Author: LaForge
Main topic: Chemie
Topic: Chemische Kunststofftechnik
School / Univ.: RWTH Aachen
City: Aachen
Published: 06.04.2010
Tags: Wintersemester 2009-2010
Card tags:
All cards (86)
Copolymerisation (2)
Haftklebstoffe (1)
Klebstoffe (7)
Plastisole (1)
Reaktionsharze (1)
Terminalmodell (1)
TPE (3)



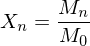
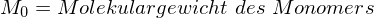
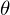 ?
?

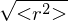
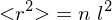
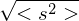
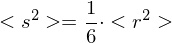
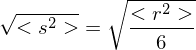
 aufgeweitet
aufgeweitet
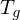 ?
?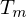 definiert?
definiert?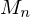 ?
?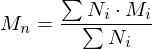
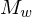 ?
?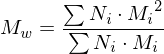
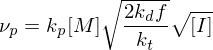
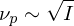
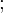
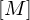
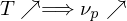
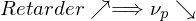
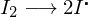
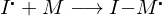
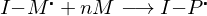



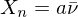 mit
mit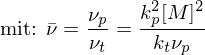
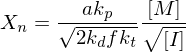

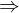 Nur ein Radikal pro Mizelle
Nur ein Radikal pro Mizelle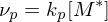 (in einer einzelnen Mizelle)
(in einer einzelnen Mizelle)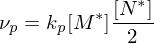

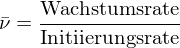
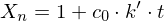
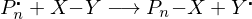
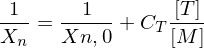
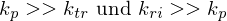
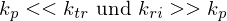
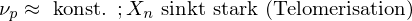
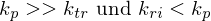
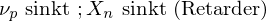
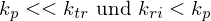
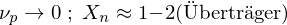
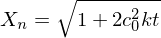
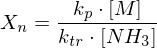
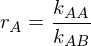
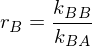
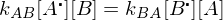
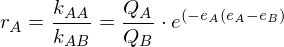
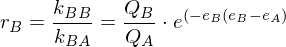
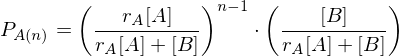
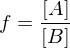
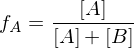


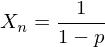
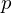 ist der Umsatz
ist der Umsatz